
新素材開発
ヤヱガキ醗酵技研では、これまで様々な研究機関様と協力し新素材の研究・知財開発を数多く行っております。現在これらの新素材(知財)のうち、最終製品の独自OEM素材として社会実装をご検討頂ける企業様にご提案可能なものをご紹介いたします。
目次
Ⅰ.β-キチンナノファイバー
1-1 キチン質からのナノファイバー開発
1-2 β-キチンナノファイバーの物性
1-3 β-キチンナノファイバーの機能性研究
1-4 β-キチンナノファイバーの受賞歴
Ⅱ. パルミトレイン酸
2-1 皮膚常在細菌叢(皮膚マイクロフローラ)と新規菌叢改善素材
2-2 ヒトの皮脂脂肪酸(サピエン酸)による常在菌叢の制御
2-3 パルミトレイン酸(POA)の選択的抗菌活性と用途開発
2-4 パルミトレイン酸の研究開発助成履歴
Ⅰ. β-キチンナノファイバー
1.キチン質からのナノファイバー開発
ナノファイバー(ナノ繊維)とは直径が1nmから100nm、長さが直径の100倍以上の繊維状物質と定義されています。現在最も産業利用が進められているのが植物の繊維(セルロース)をナノサイズまで分解した、セルロースナノファイバー(CNF)と呼ばれるもので、非常に多種多様なCNFが研究開発されています。一方で植物でなく、動物からもナノファイバーが製造できる事はあまり知られていません。
植物のセルロースはグルコースが多数繋がった多糖高分子と呼ばれる物質で、繊維構造を持ちますが動物ではキチンと呼ばれる窒素を含む糖(アミノ糖)であるグルコサミンが多数繋がった多糖高分子が繊維構造を取り、カニやエビ、昆虫などの無脊椎動物などに多く含まれています。カニなどの固い殻はこのキチンにカルシウムが結合してできており、キチンは多糖類としては植物のセルロースに次いで世界で2番目に多い生物資源であり、その量は数千億トンとも言われています。そしてキチンをセルロースと同様にナノサイズまで繊維構造を維持したまま分解したものが、キチンナノファイバー(キチンNF)と呼ばれるものになります。
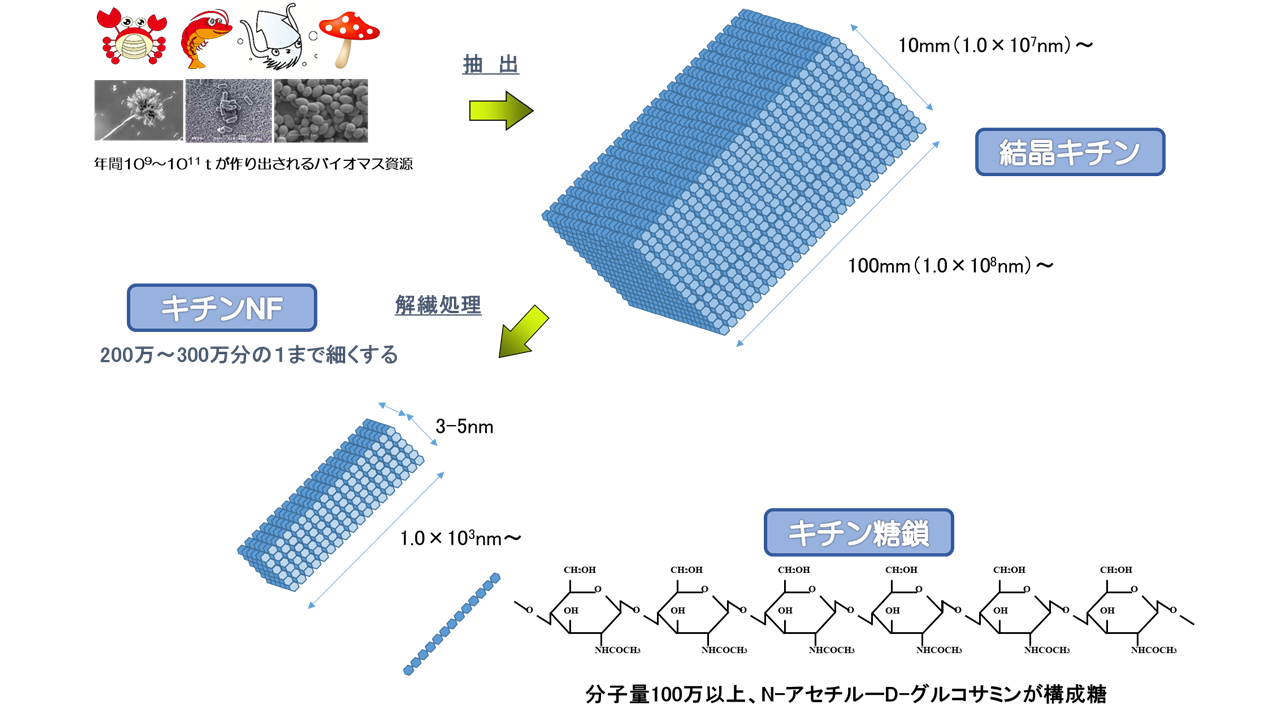
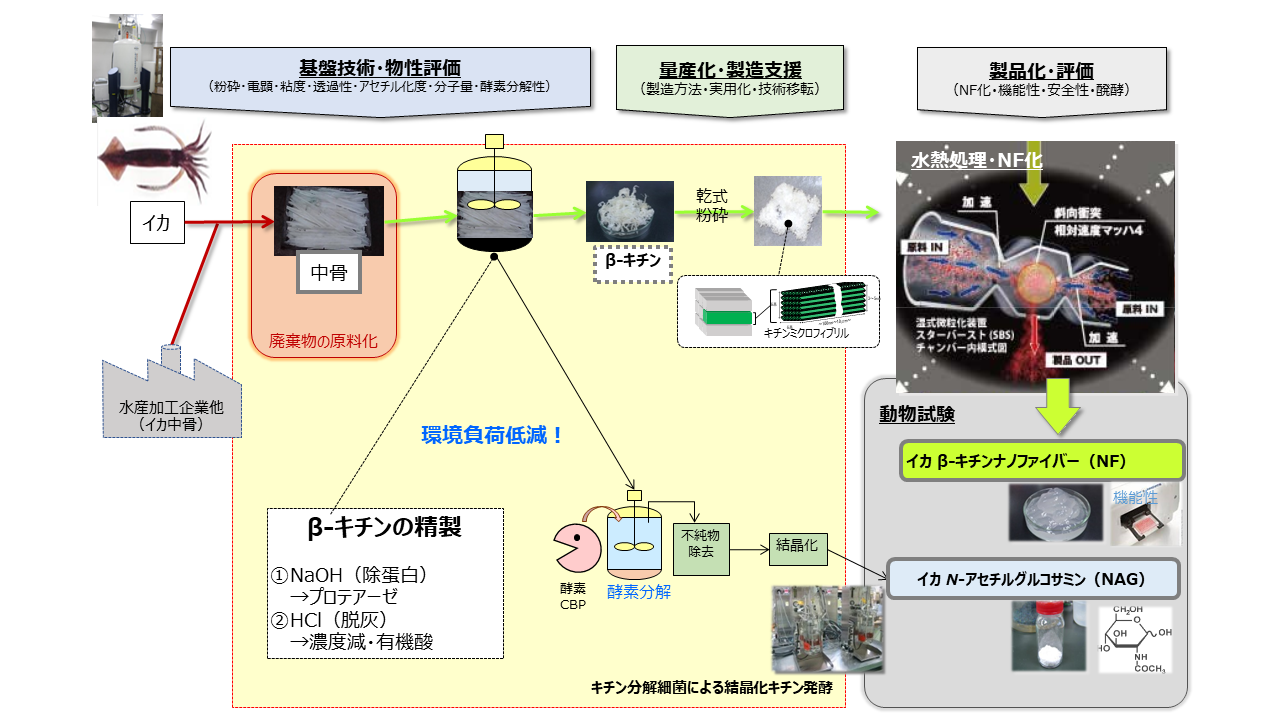
弊社では大学等の研究機関とイカ中骨に注目し、下記のような製造工程により、イカ中骨に含まれるβーキチンをβーキチンナノファイバーとして工業生産する事に成功しました。まずイカ中骨をタンク内で①除タンパク処理(アルカリ処理)を行い、次に②脱灰処理(骨のカルシウム除去:濃塩酸処理)を行いβ-キチンを精製します。それから得られたβ-キチンを乾式粉砕し、水熱処理により解繊(繊維質を分解し細かいナノファイバー化する)を行い、β-キチンナノファイバーが得られます。
またβ-キチンを精製したのち、酵素分解によりキチンの結晶化を行い、それを原料としてキチン分解細菌により発酵させる事で、サプリメント原料として知られるN-アセチルグルコサミン(NAG)を従来の製造方法(酸分解方法)に比べて工程の短縮、製造コスト1/2、製造能力10倍で製造する事も可能にしています。

2.β-キチンナノファイバーの物性
β-キチンナノファイバー(β-キチンNF)には、植物から得られるセルロースナノファイバー(セルロースNF)とは異なる物性を示すことが分かりました。特にβ-キチンナノファイバーは植物由来のセルロースナノファイバーに比べ、生体適合性が高く生体内で容易に分解する事から、下表のような医療器具助剤用途や様々な生物学的用途に適していると言えます。具体的には大学との共同研究により、β-キチンナノファイバーを用いた「マイクロ流体デバイスの開発1)」や「癒着防止材の開発2)」といった研究開発実績を持ちます。
| セルロースNF | β-キチンNF | |
|---|---|---|
| 構成糖 | D-グルコース | N-アセチル-D-グルコサミン |
| 繊維径/繊維長 | 10-100nm / 5μm以上 | 3-5nm/1μm以上 |
| 特性 | 軽量、高強度、増粘性、チキソ性 | 軽量、高強度、増粘性、チキソ性、生体特性(AD軽減、IBS改善、腸内環境改善、組織接着性、生体適合性、生分解性、止血効果、創傷治癒効果など) |
| 生分解性 | 無し | 有 |
| アレルギー性 | 無し | 無し |
また下図のように、前項の製造工程において①除タンパク処理②脱灰処理の順番を入れ替える事で、異なる繊維構造を示す事も分かりました(下表)。
| β-キチンナノファイバー(後塩酸処理) | β-キチンナノファイバー(後アルカリ処理) | |
|---|---|---|
| 外観 | 透明(10 pass) | 白濁(10 pass) |
| 透過率(600nm) | 88%(10 pass) | 68%(10 pass) |
| 分散液の粘度 | 2000 mPas (10 pass) | 310 mPas (10 pass) |
(参考文献)
1)上野ら、Kagaku to Seibutsu 60(1): 44-48 (2022)
2)長濱ら、キチン・キトサン研究 28 (2) 90-91 (2022)
3.β-キチンナノファイバーの機能性研究と用途開発例
β-キチンナノファイバーは前項の用途の他、健康維持のための食品としての様々な機能性を持つ事を調べています。ここではいくつかの機能性をご紹介します。
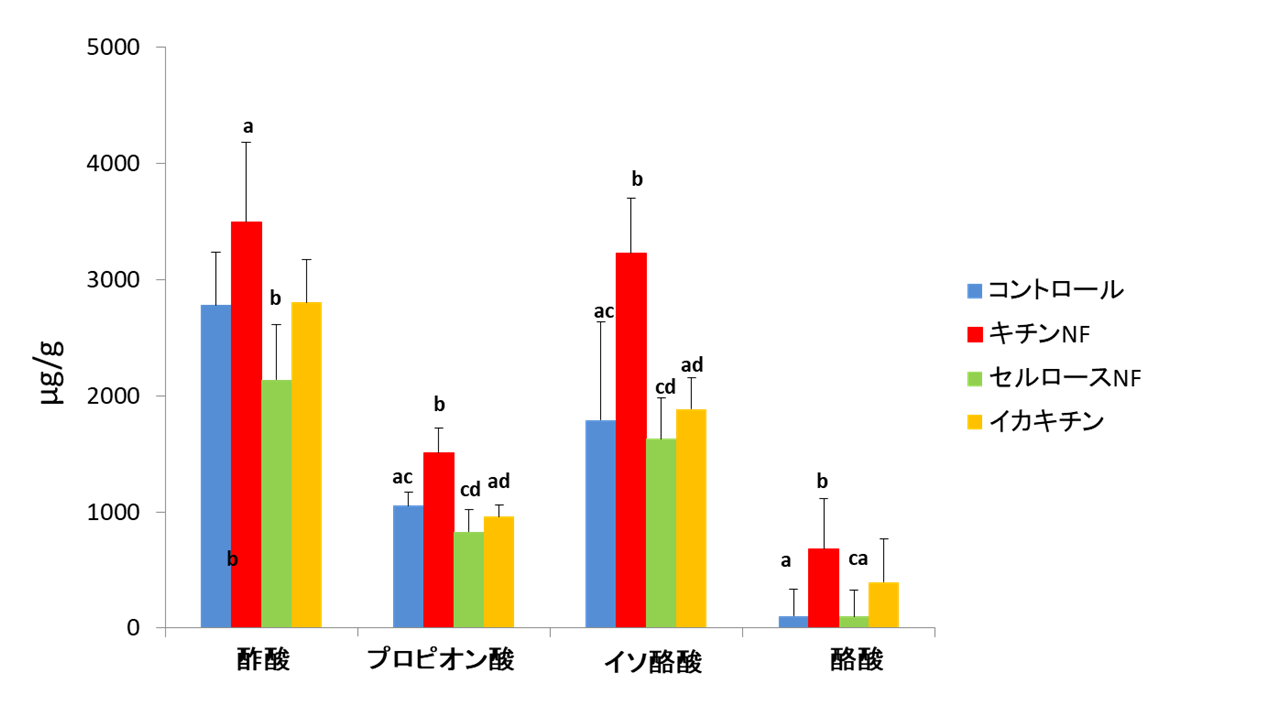
①整腸作用(盲腸内短鎖脂肪酸の増加作用)
5週齢雄性SDラットに予備飼育後、4群に分けてそれぞれ通常食群(コントロール群)とβ-キチンナノファイバー、セルロースナノファイバー、β-キチンをそれぞれ1%粉末飼料に混餌し4週間自由摂取させた各群における、腸内細菌叢の変化として盲腸内容物の各種有機酸量を測定しました。その結果β-キチンナノファイバー摂取群ではコントロール群に比べ、プロピオン酸、イソ酪酸を有意に増加させ、酢酸、酪酸を増加させる傾向が認められました。一方でナノファイバー化する前のβ-キチン摂取群ではコントロール群に比べ有機酸量の変化は認められなかった事から、β-キチンナノファイバーはナノ化処理により腸内細菌叢を変化させ、有機酸の産生を促進する事が確かめられました3)。
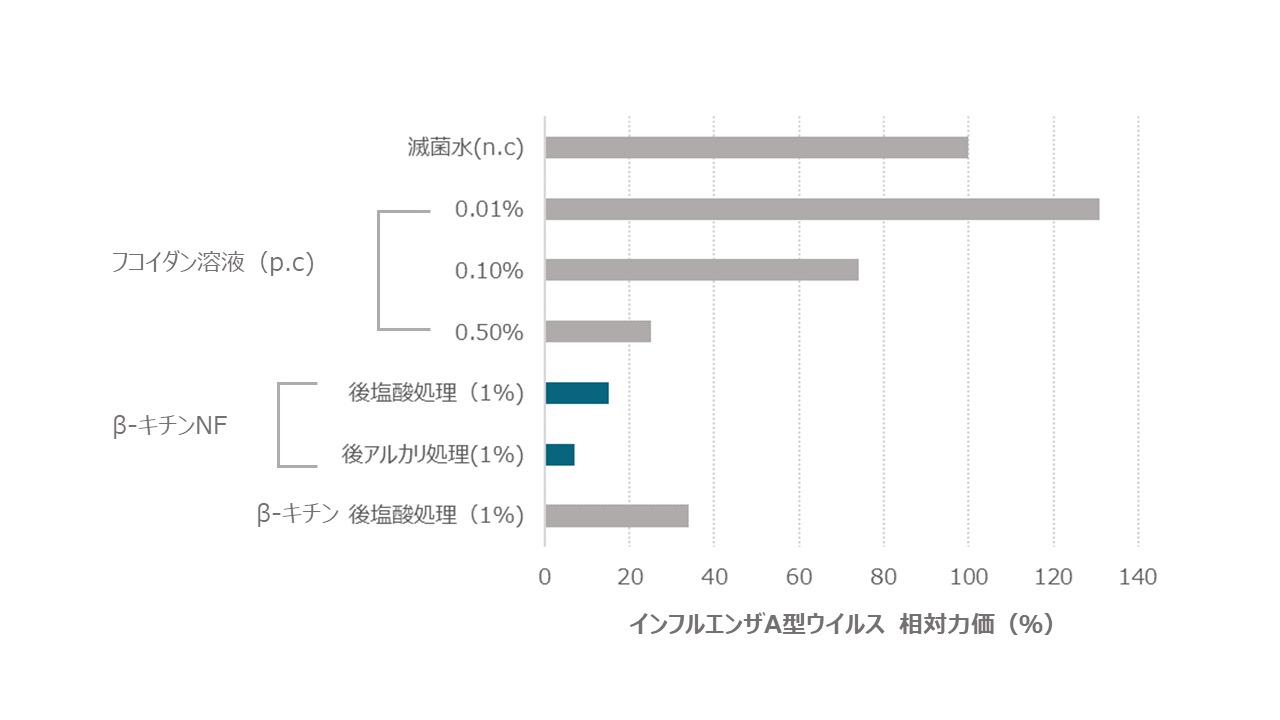
②抗ウイルス効果(インフルエンザウイルス不活性化作用)
イヌ由来MDCK細胞を播種し、調製液として1,000 TCID50*/mL A型インフルエンザウイルス液 (A/WSN/33 (H1N1)) 250 µLと各サンプル溶液 250 µLを混和し、25℃で1時間インキュベーションした後滅菌フィルターろ過後、前日播種したMDCK細胞へ添加して37℃-5% CO2下で3日間培養しウイルス力価を算出しました(TCID50* assay →Reed-Muench法)。
その結果、下図のようにβ-キチンよりナノ化したβ-キチンナノファイバー(後塩酸処理、後アルカリ処理ともに)により強いウイルス不活化作用が確かめられました。
*TCID50:Median tissue culture infectious dose
予め細胞を培養して付着させたウェルプレート上にウイルス希釈液を接種し,50%の細胞に対して感染する濃度のことを指します
(参考文献)
3)山下和彦、キチン・キトサン研究 29 (1) 1-4 (2023)
4.β-キチンナノファイバーの受賞歴
β-キチンナノファイバーは、未利用資源の活用やSDGsの観点からも優れた素材として、これまでに日本キチン・キトサン学会より令和4年度の技術賞を受賞しています。またβ-キチンナノファイバーとその製造方法について2018年度の「関西ものづくり新撰」に選定頂き、2016年度の「ひょうごNo.1ものづくり大賞」の製品・部材部門賞を受賞しております。本技術製品のOEM化にご関心をお持ち頂けた企業様は、ぜひ最下部のお問合せからご相談頂ければ幸いです。



Ⅱ. パルミトレイン酸
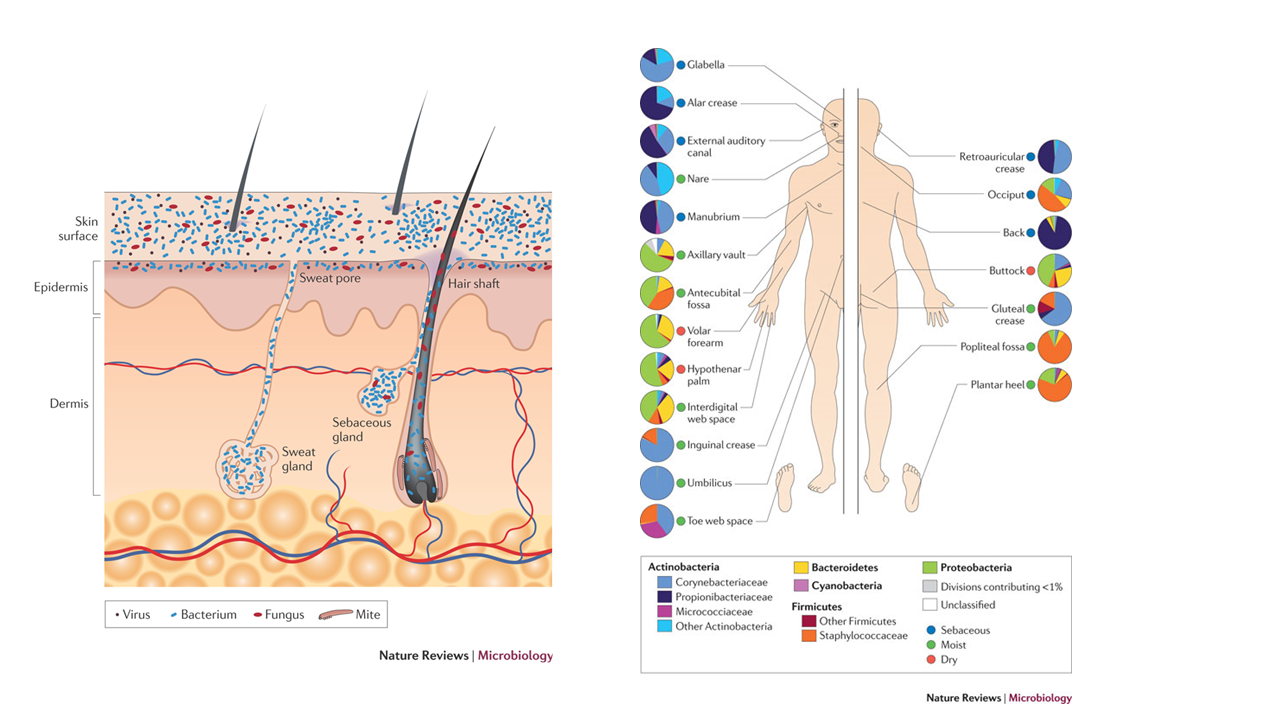
1.皮膚常在細菌叢(皮膚マイクロフローラ)と新規菌叢改善素材
現在腸内細菌に代表される共生細菌が、宿主であるヒトの腸のみならず全身の健康維持や疾患に深くかかわっている事が明かになるにつれ、腸管以外の上皮組織(皮膚、口腔内、生殖器など)に共生する細菌叢にも注目が集まりつつあります。各共生細菌叢においてヒトの健康を損なうものを悪玉菌と呼び、逆に悪玉菌の増殖を抑え、ヒトの健康を増進するものを善玉菌と呼びます。善玉菌はプロバイオティクス(生菌)製剤などに活用されていますが、それに加えて近年ではこの善玉菌を増やす働きを持つプレバイオティクスと呼ばれる素材が注目を集めています。このプレバイオティクスの代表として食物繊維などが従来よりよく研究されていました。しかしこの細菌叢のバランスを整える方法として、永尾ら1)は従来注目されていなかった脂肪酸に着目し、皮膚の常在細菌叢について非常に優れたバランス改善を行う新規天然脂肪酸を見出しました。
(参考文献)
1)永尾寿浩、化学と生物 Vol. 54, No. 7 (2016)
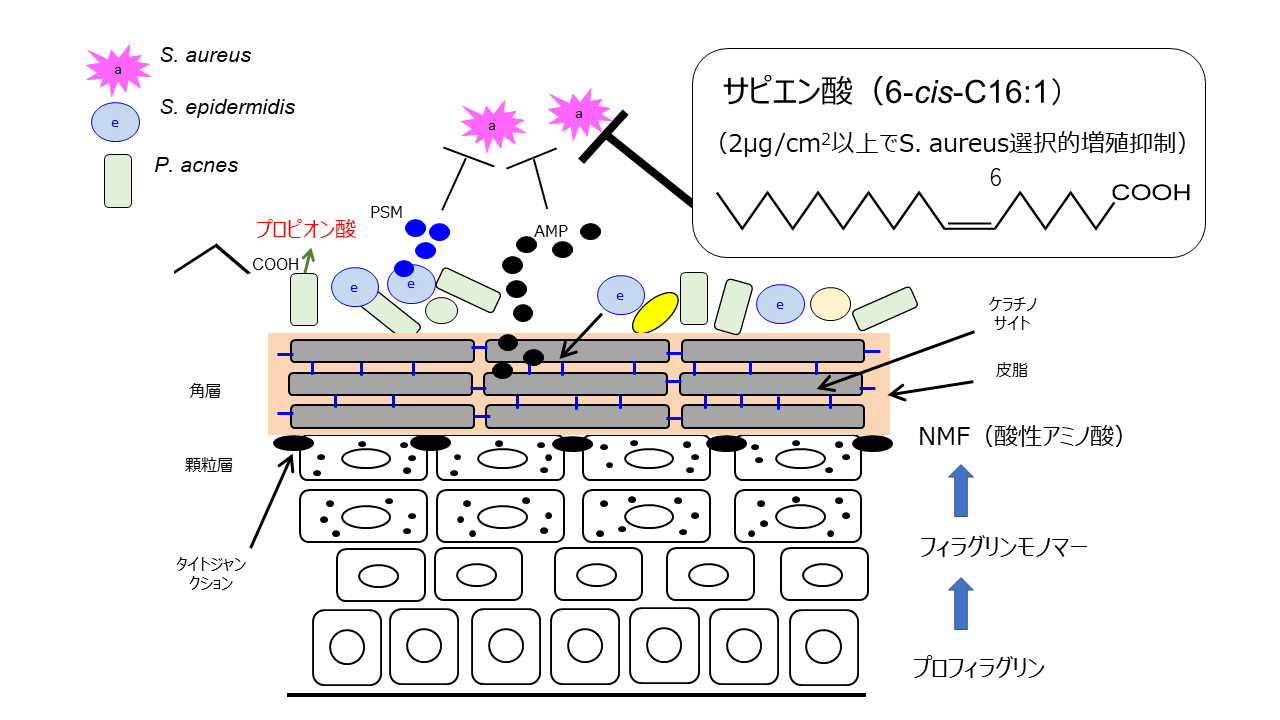
2.ヒトの皮脂脂肪酸(サピエン酸)による常在菌叢の制御
ヒトの表皮細菌叢の構成は表皮部位によって大きく異なりますが、主要な構成細菌として短鎖脂肪酸の一種であるプロピオン酸を分泌するアクネ菌Propionibacterium acnes (現在はCutibacterium acnesに再分類)と、表皮ブドウ球菌Staphylococcus epidermidis(代表的な善玉菌または日和見菌)、黄色ブドウ球菌Staphylococcus aureus(代表的な悪玉菌)が知られています。健常人の皮膚は表皮ブドウ球菌が産生する様々な物質(抗菌ペプチドAMPやβ-ディフェンシン、PSM-γなど)により黄色ブドウ球菌の増殖が抑制され、また皮脂腺から分泌される中性脂肪をアクネ菌がプロピオン酸に分解し、また同様に表皮ブドウ球菌が分泌するリパーゼによりヒト特異的な脂肪酸(サピエン酸)に分解し、表皮を弱酸性環境に保っています。このサピエン酸は脂肪酸として他の表皮脂肪酸に無いユニークな性質を持ち、黄色ブドウ球菌の増殖のみ抑制する事が知られており、これを選択的抗菌活性を呼びます。永尾らはこのサピエン酸に類似する選択的抗菌活性を持つ物質を探索した結果、パルミトレイン酸と呼ばれる脂肪酸についてある条件下でサピエン酸と同様の選択的抗菌活性を示す事を発見しました。
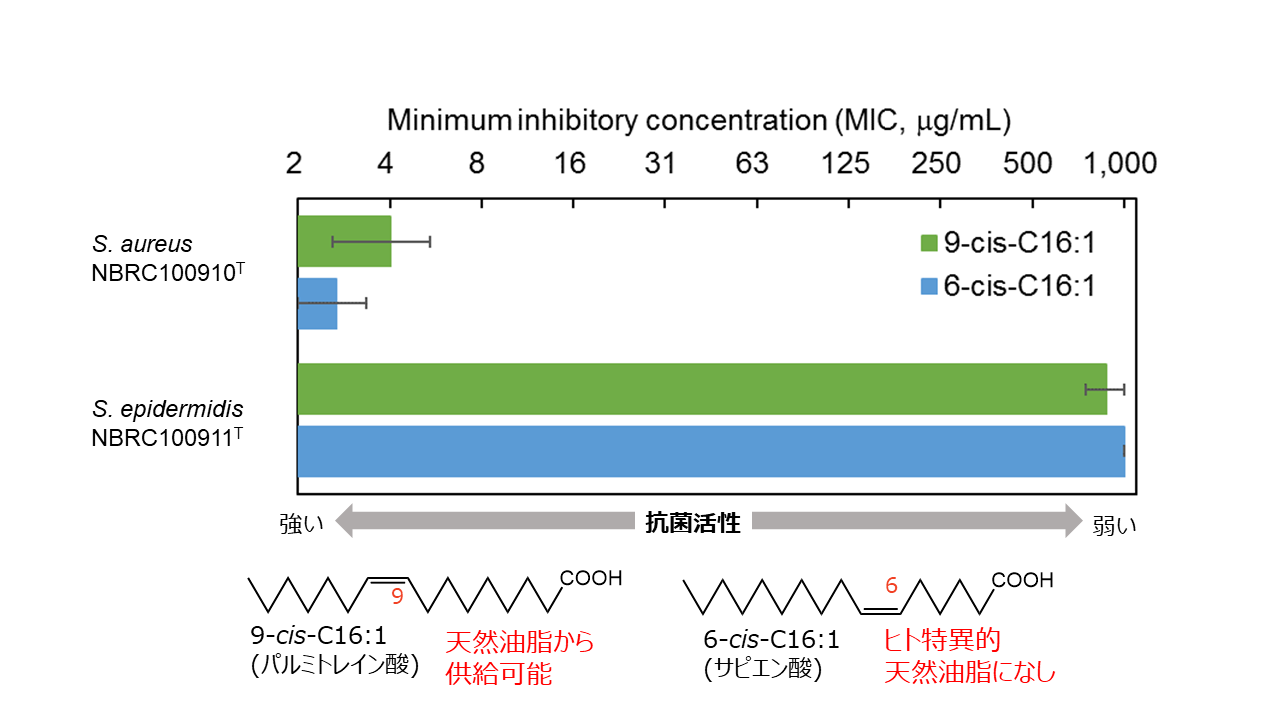
3.パルミトレイン酸(POA)の選択的抗菌活性と用途開発
永尾らの研究結果から、パルミトレイン酸(POA)がpH6.0の弱酸性環境下においてのみ、サピエン酸と同じく黄色ブドウ球菌の増殖を抑制し、表皮ブドウ球菌の増殖は抑制しない事が下図のように確かめられました。ではこのような選択的抗菌活性がどのような用途で活用できるのでしょうか?一つの可能性として、アトピー性皮膚炎(AD)の患者への応用が考えられます。ADの患者では健常人と異なり黄色ブドウ球菌が増殖しやすく、表皮ブドウ球菌が黄色ブドウ球菌を増殖抑制「できない」菌株のみ検出されるとの報告や、サピエン酸の表皮濃度が健常人の1/10以下であるとの報告があります。ADの原因や増悪はこれだけではもちろん説明できず、慢性炎症による表皮バリア機能の低下や表皮の乾燥に伴う炎症カスケード(アラキドン酸カスケード)の活性化などがあり、保湿や抗炎症などの対処も必要になります。しかしPOA塗布による菌叢の正常化は悪玉菌による炎症の増悪を抑制し、AD患者の皮膚症状の改善に繋がる可能性が示唆されており、「有用脂肪酸による表皮細菌叢制御」という新しい概念は今後常在菌の健康への多様な働きが解明されていくにつれ、さまざまな製品への応用が期待されています。弊社ではPOAの植物からの抽出・精製についてご相談を受け付けており、本技術製品のOEM化にご関心をお持ち頂けた企業様は、ぜひ最下部のお問合せからご相談頂ければ幸いです。
4.パルミトレイン酸の研究開発助成履歴
パルミトレイン酸の研究開発は下記の競争的資金による成果であり、ここに深謝いたします。
・NEDO 平成28年度 中堅・中小企業への橋渡し研究開発促進事業
・経済産業省 令和2年度戦略的基盤技術高度化支援事業
また弊社研究員によるインタビュー動画も公開されておりますので、ぜひご高覧頂ければ幸いです。